HER-2+乳腺癌再添新藥,FDA批準Margenza上市
發(fā)布日期:2020-12-17早期發(fā)現(xiàn)和盡早治療,對乳腺癌患者的生存產(chǎn)生積極影響,但是診斷為轉移性乳腺癌的患者預后仍然很差,需要進一步的治療。近日,F(xiàn)DA批準了單克隆抗體Margetuximab(Margenza,MGAH22)與化學療法的組合,用于治療已接受兩種或更多種先前抗HER2方案的成年轉移性HER2陽性乳腺癌患者(三線治療)。
Margetuximab是Fc工程改造的HER2定向單克隆抗體。Margetuximab-cmkb與人表皮生長受體蛋白(HER2)的胞外域結合。與表達HER2的腫瘤細胞結合后,margetuximab-cmkb抑制腫瘤細胞增殖,減少HER2細胞外結構域的脫落并介導抗體依賴性細胞毒性(ADCC)。
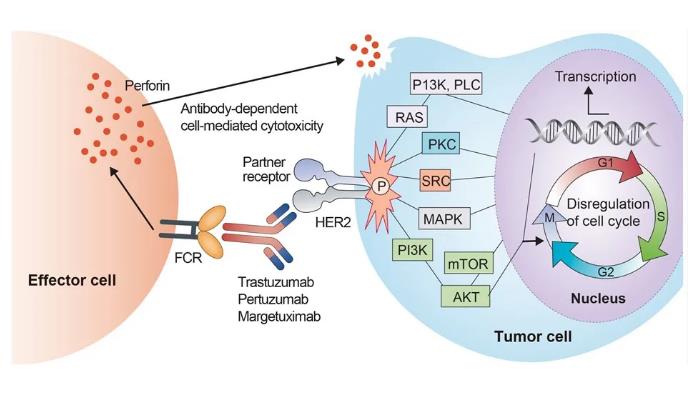
該組合的批準是基于margetuximab 聯(lián)合化學療法與曲妥珠單抗(Herceptin)聯(lián)合化療作為治療已接受過抗HER2治療的HER2陽性轉移性乳腺癌患者的SOPHIA 3期臨床試驗的數(shù)據(jù)。
在這項隨機研究中,266例患者接受了margetuximab(每3周靜脈注射15 mg / kg)聯(lián)合化療,而270例接受了曲妥珠單抗聯(lián)合化療。該研究的目的是證明實驗性margetuximab組合的療效,該組合可能為曲妥珠單抗,帕妥珠單抗(Perjeta)或TDM-1(Kadcyla)治療后復發(fā)或難治的患者提供新的選擇。為了證明療效,該研究探索了無進展生存期(PFS),總生存期(OS)和安全性的主要終點。次要終點包括研究者評估的PFS,通過獨立的放射學檢查得出的客觀緩解率(ORR),以及由任何等級的輸注相關反應的發(fā)生率定義的安全性。
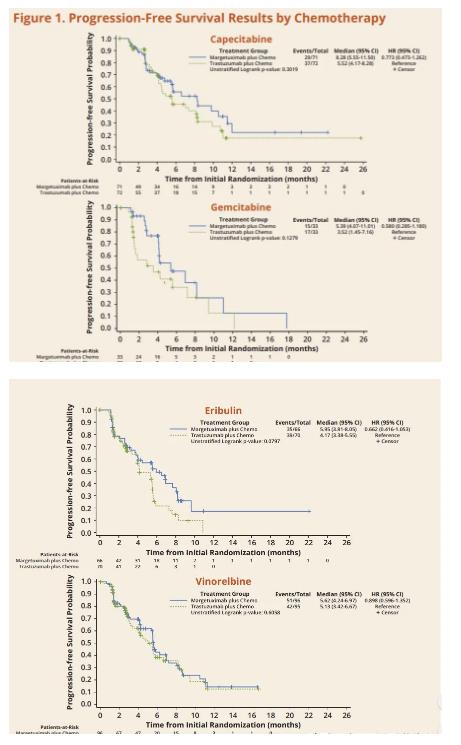
SOPHIA試驗結果表明,與曲妥珠單抗聯(lián)合化療相比,margetuximab聯(lián)合化療可使疾病進展或死亡的風險降低24%,中位PFS為5.8個月,而曲妥珠單抗聯(lián)合化療組的中位PFS為4.9個月。margetuximab聯(lián)合化療的中位OS為22%,而曲妥珠單抗聯(lián)合組的中位OS為16%。
作為一項在頭對頭3期臨床試驗中相對于曲妥珠單抗而言,僅有的顯示PFS改善的HER2靶向藥物,Margenza聯(lián)合化療是對于曾用HER2治療后出現(xiàn)進展的晚期乳腺癌患者的新選擇。





