新一代CAR T上市:53%的難治淋巴瘤,癌細胞全部消失
發布日期:2021-02-09FDA已批準lisocabtagene maraleucel(liso-cel; Breyanzi),一種靶向CD19的CAR T細胞療法,用于治療先前已接受過2種全身療法的復發或難治性大B細胞淋巴瘤成年患者(三線治療)。Liso-cel是FDA批準的針對特定類型的非霍奇金淋巴瘤的第三種基因療法。但是,CAR T細胞療法并未用于治療原發性中樞神經系統淋巴瘤的患者。
liso-cel的批準基于1期TRANSCEND NHL 001研究的主要發現,該研究達到了主要和次要終點。共同主要終點是與治療有關的不良事件(AE),劑量限制性毒性(DLT)和客觀緩解率(ORR)。次要終點包括完全緩解率(CR),緩解持續時間(DOR),無進展生存期(PFS),總體生存期(OS)和與健康相關的生活質量。總體而言,在344名患者中接受白細胞分離術的256名患者在研究中可評估療效。
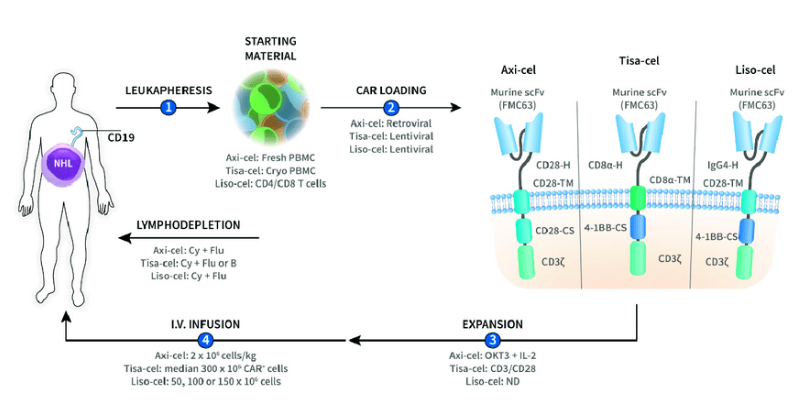
這項多中心,開放標簽,非隨機的研究仍在進行中。該研究招募了既往接受過多種治療并出現進展的患者,中位數為3種先前治療方法。納入研究的患者中有35%曾接受過自體或異體造血干細胞移植作為先前治療,而67%的患有化療難治性疾病。
該研究包括年齡在18歲以上的復發性/難治性B細胞非霍奇金淋巴瘤患者。根據Lugano分類,他們必須患有PET顯示陽性疾病,ECOG表現狀態為0或1,已經接受過CD19靶向治療,但自先前治療以來必須經過活檢證實CD19陽性淋巴瘤。如果患者在開始治療前幾天或幾周內曾接受皮質類固醇,低劑量化學療法,化學療法,免疫抑制療法,供體淋巴細胞輸注,放射線和同種異體造血干細胞移植的先前治療,則不符合資格。
結果顯示:ORR為73%(95%CI,66.8%-78.0%),超過一半(53%)的患者獲得了CR(95%CI,46.8%-59.4%)。在總體人群中尚未達到中位DOR(NR)(95%CI,8.6-NR),但6個月時的DOR為60.4%,而12個月時的DOR為54.7%。
PFS中位數為6.8個月(95%CI,3.3-14.1),6個月和12個月PFS率為51.4%和44.1%。中位OS為21.1個月(95%CI,13.3-NR),6個月OS率為74.7%,12個月OS為57.9%。
根據安全性分析,有79%的患者經歷了3級以上的治療性AE(TEAE),包括60%的患者出現中性粒細胞減少,37%的貧血和27%的血小板減少。此外,37%的患者經歷了≥3級的長期血細胞減少癥。有42%的患者觀察到細胞因子釋放綜合征(CRS)。僅2%的患者發生了≥3級CRS。解決CRS的中位時間為5天(范圍1-17)。神經系統副作用發生在30%的患者中,其中10%的嚴重程度為3級或更高,中位發病時間為9天(范圍為1-66)。解決問題的中位數時間為11天(范圍為1-86)。還需要進行上市后觀察研究,以進一步評估CAR T細胞療法的長期安全性。
“今天的批準代表了基因治療快速發展領域的又一個里程碑,”FDA的生物制品評估和研究中心Peter Marks博士說,“基因和細胞療法已經從有概念發展到實用的癌癥治療方案。”





