FDA即將批準(zhǔn)晚期宮頸癌二線新藥,有效率達(dá)70%
發(fā)布日期:2021-04-13對于復(fù)發(fā)或轉(zhuǎn)移性宮頸癌的患者,化療后出現(xiàn)進(jìn)展,尚無滿意的有效療法。近日,F(xiàn)DA已經(jīng)接受了抗體偶聯(lián)藥物tisotumab vedotin的生物制劑許可申請(BLA)并給予優(yōu)先審查,以治療復(fù)發(fā)或轉(zhuǎn)移性子宮頸癌且在化療過程中或化療后疾病進(jìn)展的患者。
Tisotumab vedotin是針對組織因子(在宮頸癌中普遍表達(dá))的抗體-藥物偶聯(lián)物,并通過蛋白酶可裂解的接頭與微管破壞劑MMAE共價連接。
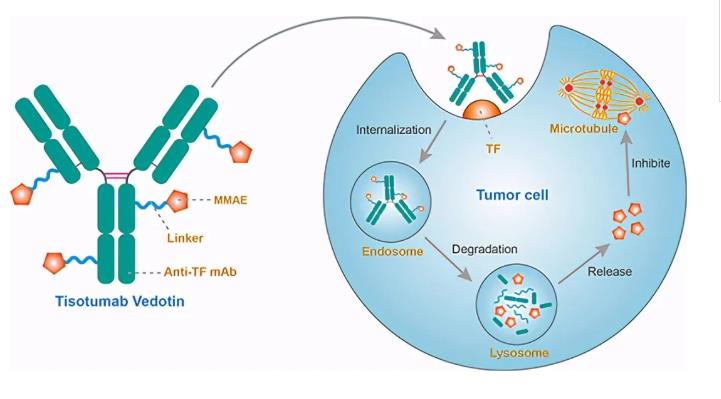
Tisotumab vedotin的批準(zhǔn)基于innovaTV 204關(guān)鍵2期臨床試驗的發(fā)現(xiàn)。試驗是對tisotumab vedotin進(jìn)行單臂,多中心的單項全球研究,該試驗用于在貝伐單抗+雙藥化療期間或之后進(jìn)展的復(fù)發(fā)或?qū)m頸癌患者。總共招募了101名患者,他們曾接受了多達(dá)2種先前的全身治療方案。客觀緩解率(ORR)是主要終點,次要終點包括研究者評估的ORR,總生存期(OS),緩解持續(xù)時間(DOR),響應(yīng)時間(TTR),無進(jìn)展生存(PFS)和安全性。
94%的患者患有盆腔外轉(zhuǎn)移性疾病,68%的患者患有鱗狀細(xì)胞癌。54%的患者先前接受過順鉑加放射治療,70%的患者先前曾接受過1種針對復(fù)發(fā)/轉(zhuǎn)移性疾病的全身性治療。63%的患者曾接受過貝伐單抗加雙藥化療作為一線治療。
結(jié)果顯示,ORR為24%(95%CI,15.9-33.3%),其中完全緩解率為7%,部分緩解率為17%,49%的患者病情穩(wěn)定。至少進(jìn)行了一次基線后掃描的患者中,有79%的患者的目標(biāo)病變減少。DOR中位數(shù)為8.3個月(95%CI,4.2 –未達(dá)到)。大多數(shù)反應(yīng)迅速,平均TTR為1.4個月(范圍1.1-5.1),并且在前兩個治療周期內(nèi)觀察到活性。PFS中位數(shù)為4.2個月,OS中位數(shù)為12.1個月。6個月PFS率為30%,6個月OS率為79%。Tisotumab vedotin表現(xiàn)出可耐受的安全性。
目前一線化療后病情進(jìn)展的復(fù)發(fā)或轉(zhuǎn)移性宮頸癌女性患者,可用的治療方法有限,Tisotumab vedotin獲得批準(zhǔn),將會為該患者群體提供一個重要的治療選擇。





