淋巴瘤新藥獲FDA批準,末線療法緩解率仍達48.3%
發布日期:2021-04-28近日,FDA已批準Loncastuximab tesirine(ADCT-402,Lonca,Zynlonta)用于治療復發或難治性(R / R)彌漫性大B細胞淋巴瘤(DLBCL)。
Loncastuximab tesirine是一種靶向CD19抗原的ADC。它由與CD19結合的人源化單克隆抗體與吡咯苯二氮平(PBD)二聚體毒素偶聯構成。一旦與CD19表達細胞結合,loncastuximab tesirine會被內化到細胞中,并釋放基于PBD的彈頭。基于PBD的彈頭有能力形成具有高度細胞毒性的DNA鏈間交聯,阻斷細胞分裂,最終導致細胞死亡。CD19是ADC療法的理想靶點,因為它在一系列B細胞血液學腫瘤(包括某些類型的淋巴瘤和白血病)中都有高表達,是治療B細胞惡性腫瘤的臨床驗證靶點。美國FDA曾授予loncastuximab tesirine治療R/R DLBCL和套細胞淋巴瘤患者的孤兒藥資格。
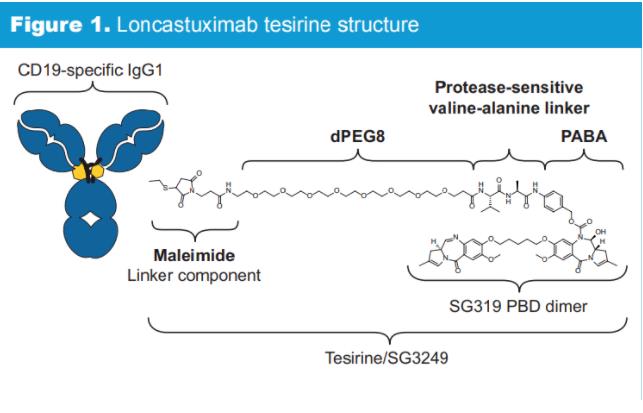
Loncastuximab tesirine的批準基于2期LOTIS-2試驗的結果,該結果表明,該藥物在接受過2種或更多以前療法的R / R DLBCL患者中引起高應答率。
LOTIS-2試驗招募了145名患者。該研究的主要結果是總體緩解率(ORR)。次要結果包括長達3年緩解期(DOR),完全緩解(CR),無復發生存期(RFS),無進展生存期(PFS),總生存期(OS),不良事件發生頻率和嚴重程度(AEs )。
在單臂研究期間,患者在每3周周期的第1天的以150μg/ kg劑量接受藥物治療,共2周期。此后,患者每個周期接受75μg/ kg Q3W,直至一年或直到疾病進展。
總ORR為48.3%,總共有24.1%的患者經歷了CR。參與者的中位年齡為66歲。患者接受過2-7種以前的全身治療,中位數為3。130位患者至少獲得了1次基線后評分。每次就診接受治療的患者的完成率達到92%或更高。經過9個療程的治療后,不到20名患者具有可用于分析的患者報告結局評分。
為了納入研究,需要病理診斷為DLBCL的患者年齡在18歲以上,先前接受過2種或多種多藥全身治療方案后患有R / R疾病。先前曾接受過loncastuximab tesirine治療,已知對CD19抗體過敏或血清ADA陽性的病史或Burkitt淋巴瘤的病理診斷的患者不符合條件。
對于患有R / R DLBCL的患者,包括已經接受過充分治療且患有難治性疾病的患者,治療選擇存在極大的需求。單藥Loncastuximab tesirine在關鍵的LOTIS-2研究中對幾種疾病亞型顯示出重要的臨床意義。值得注意的是,這包括符合移植條件和不符合條件的患者以及以前接受干細胞移植或CAR-T細胞療法的患者。
下一步計劃進行一項驗證性的3期臨床試驗LOTIS-5招募350名R / R DLBCL患者,以測試該藥物是否優于標準的免疫化學療法。





