出國看病 FDA批準首個轉(zhuǎn)移性肺癌抗PD-L1新藥
發(fā)布日期:2016-10-20專注嚴肅醫(yī)療的出國看病服務(wù)機構(gòu)愛諾美康獲悉:2016-10-18,制藥巨頭羅氏旗下的基因泰克對外宣布,美國FDA批準其PD-L1免疫檢查點抑制劑Tecentriq(藥物名:atezolizumab)用于治療前期治療失敗的非小細胞肺癌患者。
羅氏的Tecentriq將在非小細胞肺癌領(lǐng)域與默克的Keytruda和BMS的Opdivo這兩個PD-1抑制劑正式交鋒,免疫治療正式進入“三國時代”。
Tecentriq(藥物名:atezolizumab)
適應(yīng)癥:接受鉑類藥物化療期間或之后發(fā)生進展的患者;腫瘤具有EGFR或ALK基因異常并接受相應(yīng)FDA批準的靶向藥物治療后仍進展的患者。
國外批準日期:2016/10/18
中國是否獲批:否
作用機制:PD-L1抑制劑
常見不良反應(yīng):疲乏、食欲下降、呼吸急促、咳嗽、惡心、便秘。
目前羅氏給Tecentriq的定價是1.25萬美元,與競爭對手的價格基本持平。目前,Tecentriq的正在規(guī)劃超過15項肺癌臨床試驗,其中包括7項一線肺癌的III期臨床試驗。這些研究正在評估單獨使用Tecentriq或與其他藥物的聯(lián)合使用時的治療效果。
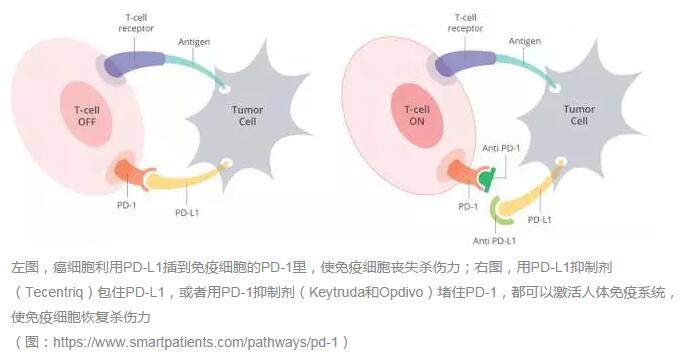
出國看病服務(wù)機構(gòu)愛諾美康介紹:作為第一個和唯一一個被FDA批準治療癌癥的PD-L1抑制劑,雖然Tecentriq在今年5月份被批準用于治療膀胱癌,但肺癌顯然是一個更大的市場。美國癌癥協(xié)會預(yù)計,2016年美國將有超過22.4萬人被診斷為肺癌,其中非小細胞肺癌將占到85%,而且其中約60%確診的肺癌處于晚期階段。

雖然Keytruda和Opdivo已經(jīng)占得先機,但是分析人士從羅氏上周在哥本哈根歐洲醫(yī)學腫瘤學會會議(ESMO)上提供的生存數(shù)據(jù)之中,看到了Tecentriq的實力與機會。
從在ESMO大會上公布的臨床III期數(shù)據(jù)來看,Tecentriq將治療失敗的非小細胞肺癌患者的中位生存期提高了4.2個月。Tecentriq組的患者中位生存時間為13.8個月,多西他賽化療組為9.6個月。Tecentriq的治療數(shù)據(jù)「基本上是前所未有的」,基因泰克癌癥免疫治療開發(fā)主管DanChen告訴FiercePharma。 他補充說,Tecentriq的臨床數(shù)據(jù)表明「Tecentriq真的有一個強大的生存效應(yīng)」。
出國看病服務(wù)機構(gòu)愛諾美康介紹:FDA批準的Tecentriq使用范圍是很廣泛的,適用于鉑化療后疾病進展的患者,或者EGFR/ALK突變陽性,但靶向治療后仍無效的患者。與BMS的Opdivo一樣,肺癌患者在接受Tecentriq治療前不必篩查PD-L1生物標志物。但是,如果患者使用默克的Keytruda治療,他們體內(nèi)的PD-L1必須達到的特定閾值才行。這對于后入肺癌市場的Tecentriq而言,無疑是個好消息。
Tecentriq是一個全新的選擇,可以幫助那些先前接受了治療卻無效的轉(zhuǎn)移性肺癌患者,該藥物不依賴PD-L1表達程度,比化療更能延長生存時間。基因泰克公司CMO兼產(chǎn)品開發(fā)主管Sandra Horning博士告訴BusinessWire,Tecentriq是第一個,也是唯一一個被批準的PD-L1免疫檢查點抑制劑。
Opdivo
在過去的15年中,晚期肺癌的生存率持續(xù)改善。肺癌幸存者肺癌基金會(ALCF)創(chuàng)始人Bonnie J. Addario告訴Business Wire,「Tecentriq的獲批對肺癌患者而言,是有一個重大的利好,增加了肺癌患者的可用藥物數(shù)量。」
Evaluate Pharma預(yù)計,到2022年Tecentriq將成為世界第14大暢銷藥物,預(yù)計當年的銷售額會達到53億美元。Bernstein則預(yù)計2021年Tecentriq的銷售額可以達到49億美元,Opdivo的銷售額可以達到81億美元,Keytruda的銷售額則為65億美元。如果那時阿斯利康的PD-L1抑制劑也獲批的話,銷售額也可以達到18億美元。
Keytruda
出國看病服務(wù)機構(gòu)愛諾美康介紹:然而,同樣在今年的ESMO大會上,默克的也公布了Keytruda的多中心隨機臨床試驗KEYNOTE-024的研究結(jié)果,Keytruda一線治療PD-L1 高表達(至少50%的腫瘤細胞表達)的晚期非小細胞肺癌(約占所有非小細胞肺癌患者的27%-30%)的療效明顯優(yōu)于化療,與化療相比,Keytruda顯著改善臨床無進展生存的主要終點(10.3個月vs 6.0個月),且不良反應(yīng)較輕,該研究結(jié)果同步刊登在臨床研究知名期刊《新英格蘭醫(yī)學》(1)上。一直以來,由于副作用大、特異性強等原因,免疫治療都是用來挽救無藥可治的癌癥患者的。此次默克Keytruda的一線臨床試驗結(jié)果表明,免疫治療的一線治療效果要優(yōu)于標準化療手段,且副作用要小,是免疫治療領(lǐng)域的一個重大里程碑事件。難怪一些知名學者在看到KEYNOTE-024的數(shù)據(jù)之后也驚呼,「變天了」,「地震了」。
出國看病服務(wù)機構(gòu)愛諾美康認為:如此種種表明,Keytruda極有可能成為非小細胞肺癌的一線治療方案之一。一旦默克的Keytruda被FDA批準用于非小細胞肺癌的一線治療,Keytruda與羅氏的Tecentriq和BMS的Opdivo誰能成為大的贏家也未可知。
出國看病服務(wù)機構(gòu)愛諾美康總結(jié)提到:2013年年末,腫瘤免疫治療被《科學》雜志評選為年度十大科學突破之首;2015年免疫治療的開創(chuàng)者之一James P. Allison獲得拉斯克醫(yī)學獎;2015年,液體活檢被評選為「十大突破技術(shù)」。可以說就在近的5年之內(nèi),癌癥的檢測和治療已經(jīng)發(fā)生了翻天覆地的變化。就目前愛諾美康轉(zhuǎn)診的腫瘤患者而言,其中肺癌約占10%,約55%的肺癌患者獲得了緩解,其中有的治療方案正式免疫藥物,相信Tecentriq的上市會為出國看病患者帶來更多的選擇和希望。
關(guān)鍵詞:出國看病,愛諾美康





