Tarlatamab / IMDELLTRA
發(fā)布日期:2024-05-20 11:22:17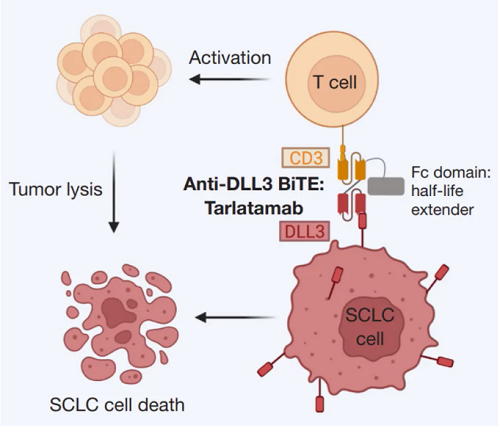
適應(yīng)癥:FDA 加速批準(zhǔn) tarlatamab 用于治療在鉑類化療期間或之后進(jìn)展的小細(xì)胞肺癌 (SCLC)患者,使其成為第一個被批準(zhǔn)用于主要實體瘤的雙特異性 T 細(xì)胞接合劑 (BiTE),也是治療廣泛期 SCLC 的第一個治療選擇。
劑型/給藥途徑:靜脈
國外批準(zhǔn)日期:2024年5月
中國是否獲批:否
作用機制:Tarlatamab(塔拉妥單抗)是一種雙特異性T 細(xì)胞接合劑(BiTE)抗體,靶向DLL3和CD3。DLL3是一種非典型的Notch信號通路的配體,在小細(xì)胞肺癌以及其它的高級別的神經(jīng)內(nèi)分泌瘤中高表達(dá)(約80%),但在正常組織中幾乎不表達(dá)。Tarlatamab可結(jié)合癌細(xì)胞上的DLL3和T細(xì)胞上的CD3,將T細(xì)胞募集到小細(xì)胞肺癌細(xì)胞附近,激活T細(xì)胞殺傷腫瘤細(xì)胞。
有效性數(shù)據(jù):接受 10 mg tarlatamab 治療的患者(1例完全緩解,39例部分緩解)的客觀緩解率為 40% (97.5% CI, 29%-52%),疾病控制率70%;而接受 100 mg 劑量治療的患者(7例完全緩解,21例部分緩解)的客觀緩解率為 32% (97.5% CI, 21%-44%),疾病控制率63%。10mg 組中 58% 的患者對 tarlatamab 至少 6 個月有反應(yīng),而 100 mg 組中這一比例為 61%。
在任一劑量水平治療的患者中,中位無進(jìn)展生存期分別為 4.9 個月(95% CI,2.9-6.7)和 3.9 個月(95% CI,2.6-4.4),中位總生存期(OS)為14.3 個月(95% CI,10.8-不可估計[NE])和 NE(95% CI,12.4-NE)。雖然 OS 數(shù)據(jù)尚不成熟,但在最后一次隨訪時,10 mg 組中 57% 的患者和 100 mg 組中 51% 的患者仍然存活。





