肝癌的代謝途徑為新的治療機會鋪平了道路
發布日期:2022-06-27香港大學研究人員發現了一種新的肝癌細胞代謝機制,即利用巨胞飲作用(一種內吞過程)吞噬細胞外蛋白作為燃料,以支持肝細胞癌 (HCC) 在缺氧(缺氧)下無限生長。這一發現表明,靶向巨胞飲作用可能代表一種新的有效治療 HCC 的方法。該研究結果現已發表在《自然通訊》上。
HCC是常見的原發性肝癌。在香港,肝癌是第五大常見癌癥,也是第三大致命癌癥,盡管治療選擇越來越多,但晚期 HCC 患者的中位預期壽命仍不到兩年。血液輸送氧氣,這是 HCC 的重要營養素。然而,由于腫瘤的生長速度異常高,包括HCC在內的實體瘤中的氧含量通常低于正常器官,遠遠超過血管的生長。HCC 細胞通過穩定一種稱為缺氧誘導因子-1 (HIF-1) 的轉錄因子對這種“營養壓力”具有高度適應性,因此對缺氧具有恢復力。
HKUMed 的研究,發現了一種新的基因 EHD2,它受 HIF-1 的調控,它啟動了一個依賴于大胞飲作用的代謝程序,以促進 HCC 細胞在“營養壓力”下適應和增殖。該研究還表明,治療性靶向巨胞飲通路可以有效抑制 HCC。
巨胞飲作用是一種內吞途徑,允許細胞吞噬細胞外蛋白質。通過共聚焦顯微鏡顯示,缺氧可使HCC細胞表現出5-10倍的巨胞飲水平誘導。通過質譜分析,HKUMed 團隊還發現被吞噬的蛋白質被消化并降解為氨基酸,這些氨基酸反過來又成為支持 HCC 細胞增殖的燃料。該過程,由 HIF-1 介導。HIF-1 轉錄激活稱為 EH 結構域的蛋白質 2 (EHD2) 的新基因,驅動膜皺褶形成,是巨胞飲作用的第一步也是關鍵步驟。
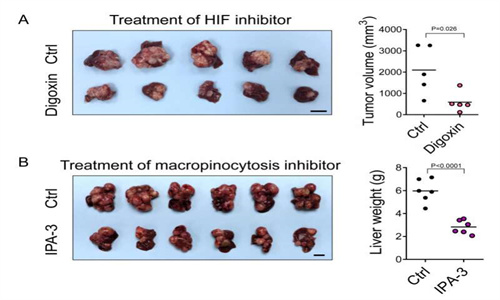
小鼠中 EHD2 的缺失阻止了 HCC 的發展。在小鼠 HCC 模型中,HIF 抑制劑、地高辛或巨胞飲抑制劑 IPA-3 的治療,也實現了超過 50% 的腫瘤負荷抑制。重要的是,在約 40% 的 HCC 患者中,EHD2 顯著過表達至少兩倍。
總之,該研究表明,HIF-1/EHD2 介導的巨胞飲作用支持 HCC 生長。抑制巨胞飲作用代表了一種有效的 HCC 治療方法。“肝癌的預后很差,部分原因是它的癌細胞足夠聰明,可以找到在貧困條件下生存的方法。因此,了解肝癌的生物學和代謝對于確定有效的治療靶點和治療方法至關重要,”卡門博士說。





