專家發現用于抗癌藥物的癌蛋白中的隱秘漏洞
發布日期:2022-07-10通常,RET 是一種具有酪氨酸激酶活性的受體蛋白,可以將磷酸基團從 ATP 轉移到其他分子,從而改變它們在對器官發生和組織維持至關重要的信號通路中的形狀和功能。RET 中的功能獲得性遺傳改變,例如產生致癌融合的點突變或染色體重排,與某些類型的癌癥有關,尤其是甲狀腺癌,以及不太常見的肺癌和乳腺癌等。
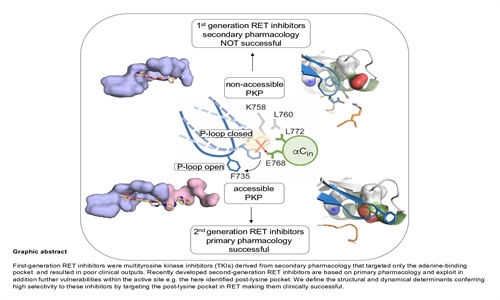
目前針對 RET 驅動的腫瘤的抗癌療法,是基于 RET 催化活性的 ATP 競爭性抑制劑。第二代抑制劑,包括 LOXO-292(selpercatinib)和 BLU-667(pralsetinib),已獲得 FDA 批準,并在癌癥患者中產生了顯著的臨床反應。
由 Ivan Plaza Menacho 領導的西班牙國家癌癥研究中心 (CNIO) 的激酶、蛋白質磷酸化和癌癥小組,已成功確定了這些抑制劑利用的結構和動態特征,特別是活性位點內的一個神秘口袋,它賦予了高對這些化合物的特異性。“與這些抑制劑復合的 RET 催化結構域的晶體結構已經得到解決,但活性位點中的隱秘口袋尚未被發現,因為由于晶體結構無法捕獲的動態和構象變化,它們并不總是可接近的” Plaza-Menacho 評論。
激酶、蛋白質磷酸化和癌癥組,專注于與癌癥有關的稱為激酶的蛋白質家族的詳細結構和功能表征。這些信息可以轉化為更好的化合物和抑制劑的設計,從而改進治療。“第二代 RET 抑制劑被 FDA 批準用于治療 RET 驅動的甲狀腺癌和肺癌,與原型 RET 抑制劑相比,它以一種不同尋常的方式與活性位點結合。但是,我們并不完全理解它們為什么會這樣如此有效,”Plaza-Menacho 補充道。





